

REDPHARM
2018-11-02
1、红细胞血管活性与氧气释放和输血疗效的关系
氧气输送是由血氧含量和流量二者共同决定的,但后者才是决定性的。具体来说,增加氧含量产生的效果是有限的(仅随血红蛋白浓度和O2饱和度线性变化),而局部血流量可能会使氧气输送增加或减少几个数量级。
在大多数情况下,主要是血流量和分布发生变化,来保持氧气输送和代谢需求之间的动态耦合。值得注意的是,经典实验证明,维持这种体内生理的是血红蛋白氧气饱和度(而非游离血浆或组织氧分压)与血流的互相耦合。
这些研究证明,红细胞既是氧气的传感器,又是血管收缩和扩张反应的调节器。红细胞已证实可在体外再现这种反应,在整个生理性氧气梯度中形成分级的血管舒张。因此,红细胞对血管的扩张会与氧气输送互相协调,且成比例。
这种耦合与血红蛋白氧气饱和度直接相关,而非与氧分压直接相关,这表明,除了作为氧气转运蛋白之外,血红蛋白还是解决组织缺氧的关键生理效应物。
一氧化氮的运输和生物利用度对红细胞为基础的血流自动调节来说是关键性的,它是通过影响循环中的反射性缺氧血管舒张来起作用的。内皮来源的一氧化氮并不直接介导调节血流量的缺氧血管舒张。
实际上,由于底物(氧气)的限制,内皮型一氧化氮合酶(eNOS)产生的一氧化氮最有可能因缺氧而减弱。此外,一氧化氮合酶(NOS)抑制剂不会阻断与血红蛋白去饱和相偶联的血流急性变化。
相反,一氧化氮似乎是被红细胞运输的,以在离一氧化氮合成原始位点相距甚远的地点和时间影响缺氧血管舒张(不过,红细胞输送的一氧化氮最初确实是从eNOS、或其他的NOS异构体或亚硝酸盐产生的)。
因此,红细胞才是控制血管的要素(其机制见图1)。
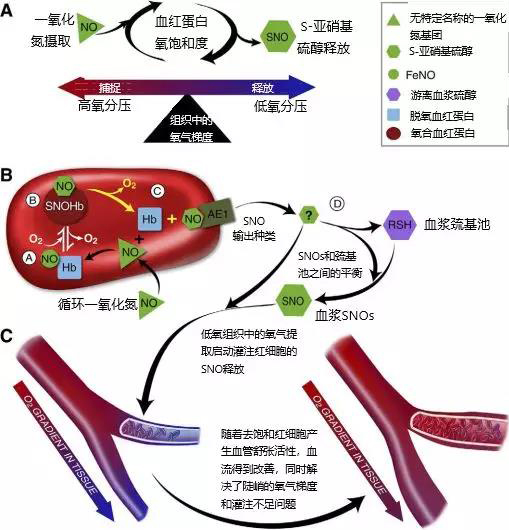
图1:红细胞通过捕获或传递一氧化氮基团来调节血红蛋白氧饱和度,转换组织中的局部氧气梯度,以控制血浆中一氧化氮的生物活性。
因此,研究人员越来越认识到,血红蛋白的构象转变(在动静脉转运期间的氧气运载和传递过程中发生的)支配着红细胞和血浆中循环的一氧化氮基团之间的交易:含氧(R状态)血红蛋白隔离、脱氧(T状态)血红蛋白释放,净一氧化氮生物活性。
因此,血红蛋白从R状态到T状态的周期驱动循环的一氧化氮基团 (通过红细胞)到血浆或细胞硫醇,以形成血管活性的一氧化氮加成物,称为S-硝基硫醇(SNO)。
这个机制提供了区域血流量和不充分灌注的生化线索之间的功能耦合,其中可能包括缺氧、高碳酸血和酸中毒(见图2)。如后所述,此机制在氧化应激和氧分压持续变化期间容易受到破坏。
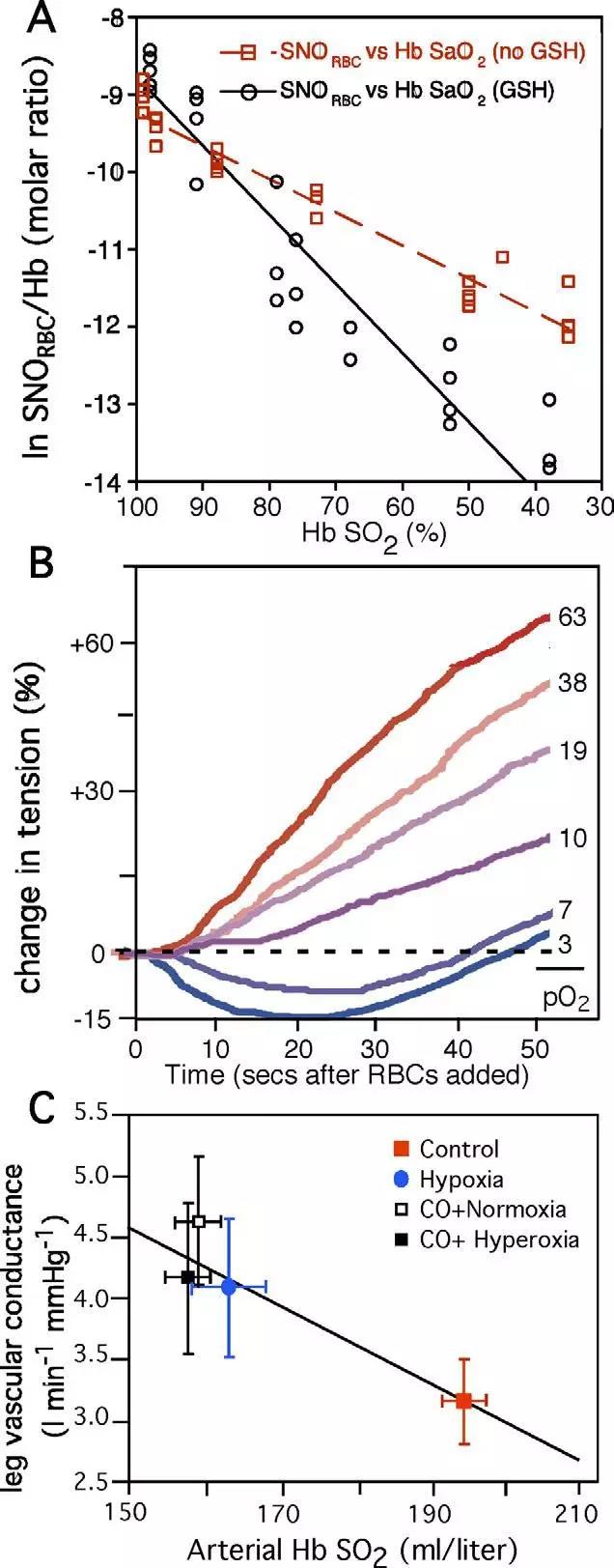
图2:血红蛋白氧饱和度(Hb SaO2)对红细胞SNO含量、红细胞血管活性和人外周血流量发挥协调性调控功能。
2、红细胞血管活性的证据:
很多证据表明,一氧化氮是通过红细胞转运到远端组织的。这种红细胞的旁分泌功能是由血红蛋白构象中的氧连转变所支配,血红蛋白的氧气饱和度因此耦合了血管扩张信号向组织氧分压的输出。重要的是,在血红蛋白存在下保持生物活性的唯一已知的内源性一氧化氮化合物就是S-硝基硫醇(SNOs)。很多数据都证实了这一点,例如,Stamler的研究团队就证明了:红细胞在低氧分压时会扩张预收缩主动脉环,而在高氧分压时会收缩。
更广泛地来看,红细胞调节的血管收缩和舒张在微循环中遇到的氧分压生理范围内进行了分级。此外,Kubes的研究团队已证实了吸入的一氧化氮在肠系膜循环中的生物活性,这与SNO的生成也是对应的。Cannon等人也观察到,一氧化氮吸入降低了曾经历过药理性一氧化氮合酶抑制的人类志愿者的前臂血管阻力。McMahon和他的同事识别出了以吸入一氧化氮为基础的活性,至少有一部分是和亚硝基血红蛋白(SNO-Hb)相关的。
此外,Reynolds的团队和Diesen的团队的研究都已表明,在红细胞中添加一氧化氮能增强血管舒张活性,以至于能生成SNO-Hb。Sonveaux的团队则报道称:输入SNO-Hb的寿命会因高氧分压而增加,在低氧分压时不稳定,这与一氧化氮本身形成鲜明的对比。还有一些研究认为SNO不受红细胞失活的影响。因此,看上去红细胞是以能按需“输出”稳定SNO到外周组织的形式来保持一氧化氮生物活性的。值得注意的是,红细胞调节的缺氧性血管舒张完全独立于内皮,并且是通过红细胞外低分子量巯基的存在而得到促进的。
3、红细胞控制血液中的一氧化氮生物活性:
对一氧化氮生物活性的“经典”理解是基于以下几个原则:(1)一氧化氮是一氧化氮合酶(NOS)的主要生物活性产物;(2)一氧化氮的寿命和出路是由一氧化氮在溶液中的扩散及其与血红蛋白(和超氧化物)的末端反应来解释的;(3)鸟苷酸环化酶的血红素中心是一氧化氮的初级受体。最近的证据表明,基于一氧化氮的信使转导比想象的复杂得多。研究人员认识到:一氧化氮主要是通过与半胱氨酸硫醇共价结合形成SNO而起作用的,不仅仅是通过可溶性鸟苷酸环化酶(sGC)来进行信使传导。
目前,在细胞和组织中已识别出大约1000种SNO蛋白,这表明SNO在一氧化氮信使转导中的核心作用。现在已经知道,通过一氧化氮和血红蛋白之间的关联应答反应(即与氧分压偶联并受CO2和pH值影响的反应),红细胞对血液中的一氧化氮基团的生物利用度起到了有效的控制作用,从而在局部、器官和系统水平上的血管信使传导中扮演了氧气供应传感器和效应器的关键角色。
因此,红细胞在呼吸循环中来回转运3种气体(NO/O2/CO2),以控制氧气的输送。对血红蛋白来说,一氧化氮生物化学的复杂性和信使传导中一氧化氮基团反应的特殊性都是很好的例子。通过在血红素中心严格调节各种反应,以及反应性半胱氨酸硫醇(βcys93),血红蛋白在循环转运过程中捕获(在b-血红素上结合一氧化氮)、激活(将b-血红素一氧化氮转换为βcys93-SNO),并运送一氧化氮基团(转亚硝基化物受体硫醇,见后文)。一氧化氮基团的血红素偶联激活是氧化化学中促进血红素一氧化氮转化为βcys93-SNO的一个要求,它受血红蛋白中氧气偶联变构转换的控制。
血红蛋白构象中的氧联变化还通过促进一氧化氮向受体硫醇转移(包括与红细胞膜蛋白AE-1相关的),再向红细胞外硫醇转移,从而启动从红细胞的SNO输出,形成血浆或其它细胞的SNO。这些SNO在低至1-5nM的浓度下仍能保持血管活性。通过调节一氧化氮基团的隔离、运输和递送来控制一氧化氮在微循环中的生物利用度,红细胞就可以在局部血流与肺中的氧气可用度及外周所需氧气之间维持适当的耦联。
4、红细胞中的亚硝基化(SNO合成)
S-亚硝基化反应的化学基础和靶向特异性的分子决定因素在其他地方已有专门研究。简而言之,血红蛋白将一氧化氮、低分子量SNO或亚硝酸盐(NO2)加工成亚硝基血红蛋白,从而模拟成一个SNO反应器。一氧化氮与血红蛋白的结合的位点是高度保守的βcys93,它符合S-亚硝基化的酸碱基和疏水基序。
更重要的是,由于βcys93微环境的构象依赖性变化,一氧化氮与βcys93连接的可能性在R结构(含氧血红蛋白)中增加,在T结构(脱氧血红蛋白)中减少。因此,S-亚硝基化在血红蛋白氧合中是得到促进的,而血红蛋白脱氧则会促进一氧化氮基团的释放。
与此对照的是,一氧化氮与血红素的结合(以NO/Hb的生理比例)在T状态下得到促进,在R状态下被抑制。当红细胞通过肺部时,氧气与血红素结合,会促进血红蛋白R结构,从而促进一氧化氮基团从血红素向巯基转移(S-亚硝基化)。(未完待续)
文章出处:
Effect of Processing and Storage on Red Blood Cell Function In Vivo
Allan Doctor, MD, and Phil Spinella, MD