

REDPHARM
2018-10-31
红细胞输血的唯一目的是改善组织的氧输送。然而,研究人员认识到,供体红细胞在加工和保存过程中已发生了根本改变,既损害了氧转运效率,又通过干扰免疫和凝血系统引入了额外的风险。
储存引起的红细胞功能的蛋白质生物物理和生理学变化被称为 “储存损伤”。例如,血液的氧亲和力在保存期间会升高,细胞内的变构调节物,特别是2,3-DPG(二磷酸甘油酸)和ATP,在储存过程中会被消耗殆尽。随着对凝血、免疫和血管信号系统的了解,研究人员对其他储存性损伤的认识也越来越深入了。
一些研究探讨了红细胞如何通过调节血浆中关键血管活性介质的生物利用度来调节区域血流与局部氧气消耗之间的关系,以及加工和存储是如何干扰这个关键信号转导功能并损害输血功效。

最近很多研究总结了红细胞在存储中发生的变化。这些研究显示,随着红细胞储存时间的延长,钾、乳酸和游离血红蛋白也会增加,而且红细胞会失去变形能力,限制了微循环的通道,而红细胞的聚集和在内皮细胞上的粘附进一步削弱了这种能力。
如前所述,2,3-DPG的浓度会随着储存时间增加而降低,氧亲和力也会升高,并在系统灌注期间限制从血红蛋白中释放氧气。红细胞的储存也会影响血液受体的免疫功能。经储存的红细胞在与血浆或全血样品孵育后会诱导多种细胞因子的改变,包括白细胞介素、磷脂酶A和超氧阴离子的增加,以及肿瘤坏死因子α(TNF α)浓度的降低。
这种现象的临床影响是在上世纪70年代由Opelz和Terasaki首次提出的,他们观察到移植前接受红细胞输血的肾脏移植患者的存活率更高。后续的研究表明,红细胞输血的免疫抑制作用与癌症复发和术后感染率的增加有关。
值得注意的是,在红细胞储存中,红细胞微粒的形成可能与输血对供体的免疫和凝血系统的影响有关。储存中的氧化损伤会导致红细胞膜微粒的形成,以及膜的生物活性脂质的释放。这种红细胞微泡含有与巨噬细胞抑制作用相关的CD47抗原。
其他数据表明,在红细胞存储过程中,促凝磷脂的生成会增加。这些生物活性脂质,如溶血磷脂酰胆碱,也被证明有促炎作用,并与输血相关性急性肺损伤有关。因此,储存过长时间的红细胞输血,也被认为通过炎症相关机制与输血相关性急性肺损伤有关。
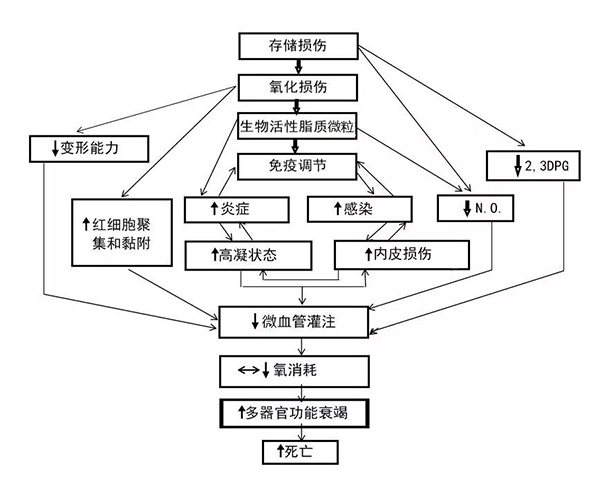
图:输注加工和存储过的红细胞之后,供体红细胞与输血受体之间的相互作用。该图说明,储存损伤对氧传输、红细胞流变性和生理/免疫调节的叠加路径有影响。
红细胞存放时间与输血效能的关系探讨:
虽然红细胞输注能增加红细胞压积,从而增加氧含量,但并不一定意味着对组织的氧输送也同样增加。而输血的目的不是仅仅提高氧气含量,而是改善氧输送。如前所述,在储存过程中,红细胞会发生根本性的变化,改变其生物功能和携氧能力。
除了作为氧载体的作用之外,红细胞还通过输出调节局部血流的血管舒张信号,在氧依赖的血管紧张性调节中发挥基础作用。加工和储存之后,红细胞的这种关键性调节功能会发生变化,导致依赖红细胞的血管调节功能受损,从而影响局部的氧气递送。
用来评估输血效果的动物模型显示:血液储存对氧气输送有不利影响。在动物休克模型中,储存时间较短的人红细胞能提高氧气消耗,而储存时间较长的红细胞则不能。在人类中,几个研究团队在危重病人输血前后测量了氧气释放和消耗量,发现红细胞输血并没有多少直接的好处。虽然红细胞输注的效果很难确定,整体或组织特异性细胞呼吸的测量也存在许多困难,但现有证据表明,输注储存的红细胞可能对微循环流动和氧利用产生不利影响。
一般来说,存储时间越长,存储损伤效应就越明显。储存时间较长的红细胞 (21-42天)与新鲜红细胞 (0-4天) 相比,炎症反应、氧化损伤介质、高凝危险性都增加了。储存时间较长的红细胞似乎也更有可能激活已被受体疾病(如脓毒症或多发创伤)引发的受体中性粒细胞,这也是输血相关性急性肺损伤的假定机制。在危重成人的研究中,储存14天的红细胞输血被发现与组织氧合减少有关,但并没有改变组织的氧饱和度。
在休克大鼠的研究中,储存3天的人红细胞增加了氧消耗量,而储存28天的人红细胞则没有。储存期延长的红细胞还被发现与危重患者的呼吸和氧气消耗降低有关。这些结果在另一个涉及22名患者的类似研究中却没有得到证实,该研究未显示红细胞储存时间的长短能影响灌注或氧气消耗,可能原因是目前还没有足够的技术水平来检测耗氧量的差异。
值得注意的是,对血液制品功效和安全性的评估来说,最好能将危重病人和非危重病人的结果分别进行分析,因为血制品的风险效益比取决于基线生理状态,危重病人和非危重病人在这方面是大不相同的。特别是边缘代偿性器官衰竭病人对于特殊损伤的耐受性较差,包括归因于输血的不良影响。(未完待续)
文章出处:
Effect of Processing and Storage on Red Blood Cell Function In Vivo
Allan Doctor, MD, and Phil Spinella, MD