

REDPHARM
2018-08-24
最新动物实验研究发现,吸氧可提高免疫细胞杀死肿瘤的能力,提示医院内常规的吸氧或许能成为肿瘤免疫治疗的辅助手段。这一振奋人心研究由美国东北大学新英格兰炎症与组织保护研究所和匹兹堡大学合作完成,结果发表在《科学》子刊《科学转化医学》杂志上。
德国生理学家瓦尔堡提出一个观点,认为癌症的产生是由于细胞糖无氧酵解增强加上氧消耗量降低造成的。这个被称为瓦尔堡效应,一直在肿瘤学研究中存在很大争议。不过肿瘤快速生长会消耗更多的氧气,而且血管的生长速度往往无法和肿瘤生长匹配,这导致实体肿瘤内细胞多处于缺血缺氧状态。
腺苷是一种遍布人体细胞的内源性核苷,是用于合成三磷酸腺苷(ATP)、腺嘌呤、腺苷酸、阿糖腺苷的重要中间体。外源性腺苷可直接进入心肌细胞,经磷酸化生成腺苷酸,参与心肌能量代谢。腺苷还能扩张冠脉血管,增加血流量。作为一种心肌保护剂,腺苷被用于临床。关于腺苷的心肌保护效应,有学者认为是研究心肌缺血预适应过程中发现的。
缺血预适应这个概念是由美国Murry教授率先发现并提出,就是非致死性缺血能引起目标心肌对抗致死性心肌缺血损伤,学术思想认为其应该来自环境适应和低氧耐受。在研究预适应基础过程中,学者们发现缺血会导致组织细胞释放大量腺苷,腺苷通过其受体启动细胞耐受能力。
正常情况下,机体可以依赖完整的免疫机制来有效地监视和排斥癌变细胞,在细胞免疫方面,T淋巴细胞、抗体依赖性细胞毒细胞、NK细胞和巨噬细胞对肿瘤细胞均具杀伤作用。如果癌变细胞本身或上述免疫细胞功能发生改变,则可能逃脱机体免疫系统的清除,恶性增生形成肿瘤。近年来研究发现,NK细胞等肿瘤免疫细胞的腺苷A2A受体活化可促使机体产生免疫耐受。
有研究发现,癌细胞和心肌细胞一样,也会在缺氧情况下产生和释放腺苷。作为一种信号转导分子,腺苷能阻断肿瘤免疫反应,从而保护癌细胞不受T细胞及自然杀伤细胞的攻击。根据最新研究,空气中的氧气浓度为21%,如果呼吸60%的氧气就足以削弱肿瘤缺氧导致免疫抑制作用,给一种肺癌和一种转移性乳腺癌小鼠模型呼吸60%的氧气,能明显缩小肿瘤,提高动物存活率。研究还发现,吸氧后肿瘤细胞周围环境变得对免疫细胞更友善,允许更多T细胞和自然杀伤细胞穿透肿瘤。免疫疗法(如注射抗肿瘤T细胞)联合吸氧后,小鼠肺癌肿瘤体积缩小效果比单纯免疫疗法更明显。正因为这项研究,目前有一个针对肺癌病人的临床试验,其正在测试补充氧气与一种癌症疫苗的组合疗法。
虽然氧气是生命不可缺少的,对人体也是有毒的气体,长期呼吸纯氧对肺损伤十分严重,呼吸60%氧气(准确说,是氧分压为60 kPa,浓度和气体效应不相关,例如在高原上发生缺氧,但氧气比例也是21%,但分压下降)或以下就比较安全,可长时间呼吸。有人或许觉得,如果用高压氧,可以增加氧气的效应,是否能获得更理想的效果。当然有可能,不过高压氧毒性更大,所以只能短时间用,效果好不好,需要实验证明。
目前,高压氧联合化疗、联合放疗的探索,尤其是氧和放疗结合(因为氧气本身是放射增敏剂)可以提高放射治疗效果。不过,氧疗在提高治疗效果的同时,也对正常组织带来许多危害,比如氧中毒。
如果纯氧对于癌症治疗存在先天无法避免的缺陷,那么我们换一种思路,既然腺苷阻碍放化疗及自身免疫系统对癌细胞的清除,而细胞释放腺苷又是一种应激反应,通过控制细胞应激反应减少腺苷释放用,是不是一种全新的癌症治疗途径呢?目前又有没有一款试剂既拥有氧疗效果(高效输送氧气),同时兼具减少应激反应,最重要的是适当剂量不会产生不良影响呢?

答案是肯定的。目前国内唯一一家牛源血红蛋白研发公司润方生物(REDPHARM)已经开发了一种超纯高效生物供氧剂,可以有效解决癌症氧疗中遇到的难题。
血红蛋白在红细胞中具有载氧功能,其由4条多肽链构成,亚基间的协同效应决定血红蛋白的载氧能力。血红蛋白在红细胞外仍具有运输氧的能力,符合人体生理特点,接近机体正常的代谢途径。但单独输注对机体具有较大的毒性反应,为避免不良反应,所以采用表面修饰、分子内交联、脂质体包裹等方式合成Hemoglobin-based oxygen carrier,相对直接暴露于基质的血红蛋白修饰物,包裹的血红蛋白对机体的毒性更小。Hemoglobin-based oxygen carrier体积远小于正常红细胞,黏度较低,易通过普通血细胞无法通过的微小血管进行有效灌注,抑制糖酵解及乳酸产生,减少缺血性再灌注损伤。另外,Hemoglobin-based oxygen carrier具有良好的携氧释氧能力,其P50值、Bohu效应,Hill系数等都与全血相似,能够达到各组织的氧供需要求。
Hemoglobin-based oxygen carrier不但可以增加血液的载氧功能,且其释放氧到组织的能力比红细胞内血红蛋白更强。通过介入技术向缺血血管输注Hemoglobin-based oxygen carrier后使缺血脑组织得到灌注,可在加大血流量的同时降低血黏度,以提高氧供能力。Hemoglobin-based oxygen carrier的P50值(氧饱和度为50%的氧分压)决定其氧弥散力的强弱,P50值越高,其释放氧到组织的速度越快,氧的亲和力越低。Hemoglobin-based oxygen carrier较低的氧亲和力(Hemoglobin-based oxygen carrier的P50是40mmHg,细胞内血红蛋白的P50是27mmHg)使其比体内血红蛋白释放氧到组织的速度快3倍。Hemoglobin-based oxygen carrier不仅可在常温下长期保存,且无需在输入人体前交叉配型,因此,认为Hemoglobin-based oxygen carrier可安全有效地应用于临床应用中。
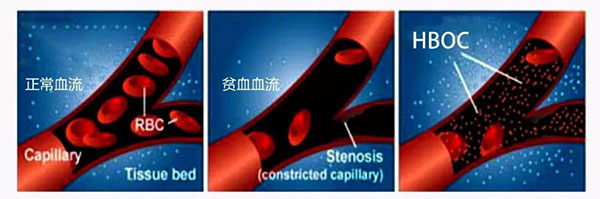
相比较于纯氧灌输,润方生物供氧剂((Hemoglobin-based oxygen carrier)具有稳定血液动力优势,进入肌体后,Hemoglobin-based oxygen carrier在血浆中循环,可迅速提高血液中血浆血红蛋白与总血红蛋白浓度,使乏氧的组织和器官得到氧气的充分灌注,同时也能稳步提高红细胞自身的氧气运输能力。结合全球领先的蛋白分离纯化技术与去病毒工艺,对Hemoglobin-based oxygen carrier进行化学修饰后,并通过质量控制,使其具有适宜的粒径分布,大大提高了Hemoglobin-based oxygen carrier的安全性,也降低了其在临床应用中的不良反应。
此外,值得关注的一点是,润方生物供氧剂(Hemoglobin-based oxygen carrier)输入超过3个单位的红细胞或等效剂量Hemoglobin-based oxygen carrier(10个单位,250ml/单位)以上剂量时,理论上会对血管产生收缩效应。血管收缩的原因主要为无基质血红蛋白作用、氧的“自调节理论”(输注过量氧至终末微动脉导致血管反射性收缩)。这是细胞氧化应激反应的一种体现,不过重要的不是Hemoglobin-based oxygen carrier会产生氧化应激,而是“氧化应激”会对癌症治疗的关键因素腺腺的释放产生重要影响。通过对“2型糖尿病患者氧化应激状态与红细胞腺苷酸代谢的关系”研究发现,氧化应激与细胞腺苷释放有着密切关系,而且部分氧化应激会显著减少细胞腺苷释放。
倒推回去,我们会发现一个有趣的现象:c一方面正常输注可以通过输送氧气提高免疫细胞杀死肿瘤以及放化疗治疗效果(氧气是放射增敏剂),另一方面过量输注会产生血管收缩造成——“氧化应激”进而降低细胞腺苷的释放(细胞腺苷释放与自身免疫负相关)提高抗癌免疫力。抛开无基质血红蛋白的寡聚体需要通过肾脏排泄(增加肾中毒风险),Hemoglobin-based oxygen carrier具有无可比拟的癌症治疗研究应用前景。